Организм убил одни клетки ради спасения других
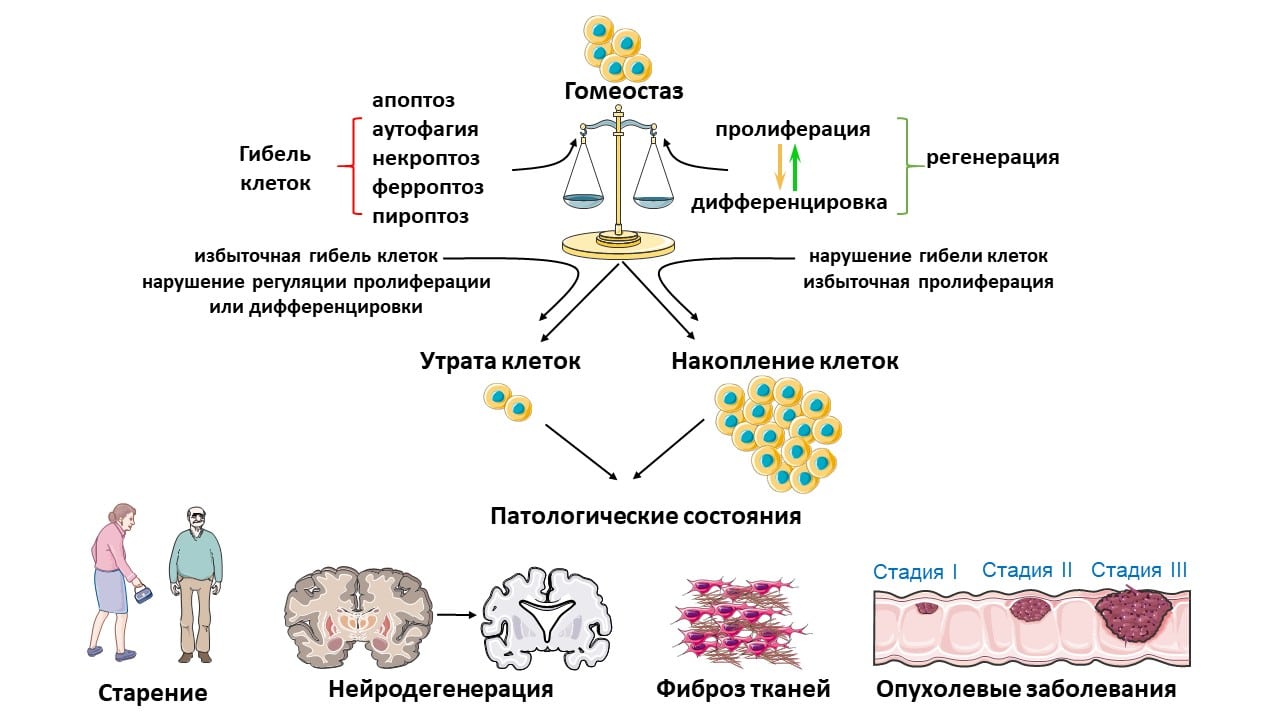

Баланс между гибелью и образованием клеток в организме — залог правильного функционирования органов и тканей / © Гелина Копеина, Анастасия Ефименко, пресс-служба РНФ
Организм убил одни клетки ради спасения других
Результаты исследования, поддержанного грантами Российского научного фонда (РНФ), опубликованы в журнале Physiological Reviews.
В организме человека ежедневно погибают миллионы клеток, и в норме этот процесс строго контролируется. Программируемая гибель клеток играет важную роль в обновлении и регенерации (восстановлении) тканей. С ее помощью организм избавляется от клеток, выполнивших свою функцию, а также от поврежденных и неправильно функционирующих клеток, например опухолевых или стареющих. Баланс между делением, дифференцировкой (специализацией) клеток и их гибелью обеспечивает нормальное развитие и функционирование живого организма.
Нарушение такого баланса приводит к развитию ряда заболеваний, таких как рак, фиброз — избыточное разрастание соединительной ткани, — нейродегенеративные расстройства и многие другие. Поэтому один из рациональных способов борьбы с такими патологиями — направленное воздействие на эффективность программируемой гибели клеток, восстанавливающее ее до оптимального уровня в каждом необходимом случае. Для этого нужно четко знать механизмы, приводящие клетки к гибели.
Ученые из Института молекулярной биологии имени В.А. Энгельгардта РАН (Москва) и Московского государственного университета имени М.В. Ломоносова (Москва) проанализировали более 300 исследовательских работ, посвященных разным типам программируемой гибели клеток, которых на сегодняшний день открыто более десяти, и их связи с процессами регенерации.
Наиболее изучен на настоящий момент апоптоз — тип гибели, при котором от умершей клетки остаются небольшие фрагменты, окруженные мембраной (апоптотические тельца). Они «поедаются» макрофагами — клетками иммунной системы, очищающими поврежденную ткань от остатков мертвых клеток. Именно поэтому апоптоз никогда не сопровождается воспалением.
Противоположный апоптозу по механизму тип гибели — некроз — характеризуется тем, что гибнущая клетка просто разрывается, и ее содержимое изливается в окружающее пространство, что вызывает воспаление в ткани.
«Еще один распространенный тип программируемой гибели клеток — ферроптоз, который запускается при железо-зависимом окислении фосфолипидов (компонентов клеточных мембран) и сопровождается накоплением активных форм кислорода. Это молекулы, в большом количестве способные повреждать мембраны, ДНК, белки и другие компоненты клеток», — поясняет руководитель проекта, поддержанного грантом РНФ, Гелина Копеина, доктор биологических наук, заведующая лабораторией исследования гибели клеток ИМБ имени В.А. Энгельгардта РАН.
Проведенный авторами анализ показал, что разные варианты гибели клеток неодинаково влияют на восстановление поврежденных тканей. Например, при апоптозе клетки выделяют небольшие пузырьки — везикулы ApoEVs, — содержащие ДНК, РНК, белки и липиды. Эти структуры служат сигналом к активному росту и размножению для соседних здоровых клеток. Благодаря такому механизму соблюдается баланс между удалением и восполнением клеток. В экспериментах на крысах препараты с везикулами ApoEVs ускоряли заживление ран на 40%.
Исследования также показали, что в определенных случаях воспаление в ткани, возникающее при некрозе, может быть полезным. Так, гибнущие этим способом клетки выделяют в окружающую среду связанные с повреждениями молекулы DAMPs. Такие соединения привлекают макрофаги. Важно, что макрофаги не только удаляют из ткани остатки мертвых клеток, но и активируют стволовые клетки и тем самым способствуют регенерации тканей. В исследованиях, проведенных на мышах, было показано, что некроз необходим для нормального восстановления изолирующих оболочек нервных клеток в головном мозге.
Однако такое же стимулирующее влияние апоптоз и некроз могут оказывать и на раковые клетки, ускоряя рост опухолей и повышая риск рецидивов. Ведь опухолевые клетки используют те же программы для размножения, которые есть в нормальных тканях. Поэтому роль этих типов гибели клеток оказывается неоднозначной и требует дальнейшего исследования, а воздействие на них с целью терапии должно применяться с большой осторожностью.
Интересно, что стволовые клетки часто оказываются устойчивыми к процессу программируемой гибели благодаря активному синтезу антиапоптотических белков и эффективным механизмам восстановления повреждений в ДНК. Это свойство важно для того, чтобы сохранять и поддерживать «запас» клеток, которые при необходимости способны заместить своих поврежденных «соседей». Известны также виды стволовых клеток, чувствительных к определенным типам программируемой гибели клеток, однако механизмы этого эффекта остаются до сих пор недостаточно понятными.
«Большое количество экспериментальных работ подтверждают, что гибель клеток — это не просто разрушение, а сложный регулируемый процесс, который может как способствовать, так и препятствовать регенерации. Знания о том, в каких условиях запускается тот или иной тип гибели и какие эффекты он несет для организма, будут полезны для разработки новых подходов к терапии возрастных заболеваний и эффективного лечения травм. В дальнейшем мы планируем более детально разобраться в том, как можно повлиять на взаимодействие между делением и гибелью клеток, чтобы стимулировать регенерацию органов и тканей. Кроме того, мы проверим эффекты такого воздействия на различных животных моделях», — рассказывает участник проекта, поддержанного грантом РНФ, Анастасия Ефименко, доктор медицинских наук, заведующая лабораторией репарации и регенерации тканей Центра регенеративной медицины МНОИ МГУ имени М.В. Ломоносова. Источник материала и фото: "Naked Science"







